本报讯 来自上海交通大学系统生物医学研究院和美国约翰霍普金斯大学的研究人员利用蛋白质组芯片,以大肠杆菌为模型,发现了一种全新的蛋白质去乙酰化酶YcgC,这一研究成果于2015年12月30日在eLIFE杂志在线发表。
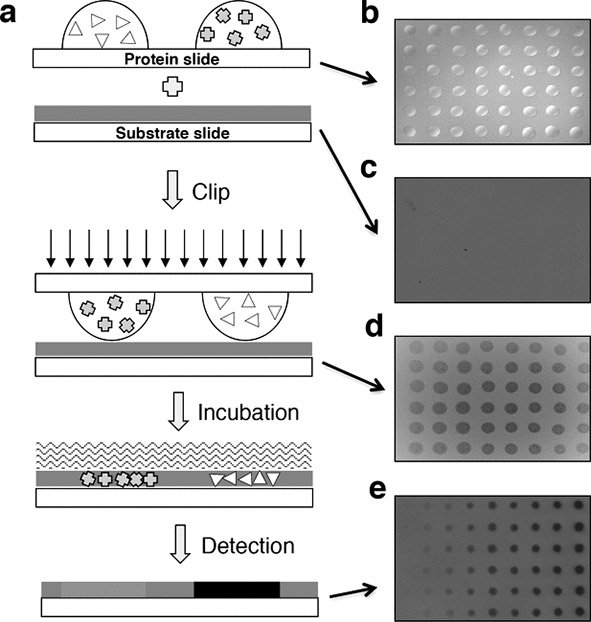
蛋白质是由基因所编码,在其生命周期内往往会被打上不同类型的修饰,而且这些动态变化的修饰会以极其精细的方式影响和调控蛋白质的功能。乙酰化作为一种重要且广泛存在的蛋白质翻译后修饰类型,影响众多关键的生物学过程,并且与一系列重要疾病密切相关。随着蛋白质组技术的进步,目前已经从低等的大肠杆菌到高等的人等众多生物细胞中发现了成千上万的乙酰化修饰。蛋白质的乙酰化由乙酰转移酶和去乙酰化酶调控。对应海量的蛋白质乙酰化修饰,目前已知的乙酰化酶和去乙酰化酶数目却非常有限。针对“如何高效地发现乙酰化相关酶”这一问题,本文作者发展了一套称之为“Clip-chip”的技术,即在大肠杆菌蛋白质组芯片的基础上,进行了全局性蛋白质去乙酰化酶的发现,并发现了一种新的去乙酰化酶YcgC。该酶能够高效地去除底物蛋白RutR赖氨酸52位和赖氨酸62位的乙酰化。已知蛋白质去乙酰化酶的活性依赖于NAD+或者Zn2+,但YcgC的去乙酰化活性并不依赖于以上两者。进一步的功能实验表明,YcgC通过去乙酰化影响RutR的转录调控活性。在实验中作者还发现RutR具有蛋白酶活性,而YcgC通过去乙酰化能够调节RutR的蛋白酶活性。作者比较了YcgC与大肠杆菌中唯一的去乙酰化酶CobB对大肠杆菌表达谱的影响,结果表明,两者既有相似点,也有不同,提示YcgC与CobB的底物谱可能有较大不同。通过全基因合成,作者获得了来源于多个其它细菌的大肠杆菌YcgC的同源基因克隆,表达测试表明这些克隆所表达的蛋白均具有蛋白质去乙酰化酶活性。
本研究所发现的YcgC可能代表一个全新的蛋白质去乙酰化酶家族,同时研究中所发展的Clip-Chip技术具有通用性,可方便地移植于其它酶的发现中。
该研究得到自然科学基金以及科技部863计划的资助,文章共同第一作者分别为上海交通大学系统生物医学研究院的涂顺和郭书娟、台湾中央大学的Chien-sheng chen(陈健生)副教授。上海交通大学系统生物医学研究院陶生策研究员及约翰霍普金斯大学的朱衡教授和Philip A.Cole教授是本文的通讯作者。
(系统生物医学研究院 陶生策)
